1. Tên hoạt chất và biệt dược:
Hoạt chất : Itraconazole
Phân loại: Thuốc kháng nấm.
Nhóm pháp lý: Thuốc kê đơn ETC – (Ethical drugs, prescription drugs, Prescription only medicine)
Mã ATC (Anatomical Therapeutic Chemical): J02AC02.
Brand name: SPORANOX IV
Hãng sản xuất : Janssen-Cilag
2. Dạng bào chế Hàm lượng:
Dạng thuốc và hàm lượng
Mỗi mL: Itraconazol 10mg.
Dung dịch đậm đặc pha dịch truyền: lọ 25mL.
Dung dịch SPORANOX IV 10 mg/mL đậm đặc và dung môi để pha dịch truyền (dung môi pha tiêm Natri Clorid 0,9%) được đóng gói thành một bộ bao gồm:
Dung dịch thuốc đậm đặc SPORANOX IV 10 mg/mL để truyền, một dung dịch không màu được chứa trong một ống tiêm 25mL bằng thủy tinh loại I không màu.
50 mL dung môi pha tiêm Natri Clorid 0,9% dùng để pha dịch truyền, được chứa trong một túi truyền polypropylen.
Dây nối có khóa van 2 chiều và bộ lọc bên trong.
Thuốc tham khảo:
| SPORANOX IV | ||
| Mỗi ml dung dịch có chứa: | ||
| Itraconazole | …………………………. | 10 mg |
| Tá dược | …………………………. | vừa đủ (Xem mục 6.1) |


3. Video by Pharmog:
[VIDEO DƯỢC LÝ]
————————————————
► Kịch Bản: PharmogTeam
► Youtube: https://www.youtube.com/c/pharmog
► Facebook: https://www.facebook.com/pharmog/
► Group : Hội những người mê dược lý
► Instagram : https://www.instagram.com/pharmogvn/
► Website: pharmog.com
4. Ứng dụng lâm sàng:
4.1. Chỉ định:
SPORANOX IV được chỉ định để điều trị các trường hợp nhiễm nấm toàn thân:
Nhiễm nấm Aspergillus;
Nhiễm nấm Candida;
Nhiễm nấm Cryptococcus (bao gồm viêm màng não do Cryptoccocus): trên những bệnh nhân suy giảm miễn dịch nhiễm Cryptococcus và trên mọi bệnh nhân nhiễm Cryptococcus ở hệ thần kinh trung ương, SPORANOX IV chỉ được sử dụng khi điều trị ban đầu được coi là không phù hợp hoặc đã chứng minh không hiệu quả;
Nhiễm nấm Histoplasma.
SPORANOX IV cũng được chỉ định trong điều trị theo kinh nghiệm trên những bệnh nhân sốt giảm bạch cầu mà nghi ngờ nhiễm nấm toàn thân.
4.2. Liều dùng Cách dùng:
Cách dùng :
Itraconazol có khuynh hướng kết tủa khi 25mL SPORANOX IV đậm đặc được pha trong các dung môi khác 50mL dung môi pha tiêm Natri Clorid 0,9%. Tổng lượng đầy đủ 25mL SPORANOX IV đậm đặc từ ống tiêm phải được pha vào trong túi truyền, là túi được thiết kế chuyên biệt để dùng với dung dịch thuốc SPORANOX IV. Chỉ sử dụng các thành phần của đơn vị đóng gói bán hàng (như túi truyền, dây nối với khóa 2 đầu và bộ lọc trong ống 0,2µm, và ống tiêm SPORANOX IV). SPORANOX IV không được truyền chung với bất kỳ loại thuốc hay dung dịch nào khác (xem Tương kỵ).
Trước khi bắt đầu quá trình pha, dung dịch tiêm NaCl 0,9% và dung dịch SPORANOX IV đậm đặc phải được kiểm tra bằng mắt thường. Chỉ những dung dịch trong suốt không lẫn bất kỳ phần tử nào khác mới được sử dụng để pha.
Tổng lượng dung dịch SPORANOX IV đậm đặc phải được bơm vào túi truyền trong một lần bơm chậm duy nhất (lên đến 60 giây). Trong suốt quá trình pha, có thể xuất hiện màu trắng sữa nhưng sẽ trở nên trong suốt sau khi pha trộn nhẹ nhàng. Khi kiểm tra bằng mắt thường túi truyền sau khi pha và trước khi truyền, có thể quan sát thấy tủa sản phẩm nội tại. Tủa này không ảnh hưởng chất lượng của sản phẩm. Dây nối chuyên biệt với bộ lọc 0,2µm phải được sử dụng để ngăn các tủa này đi vào hệ tuần hoàn của người nhận.
xem Hình 1a & 1b.


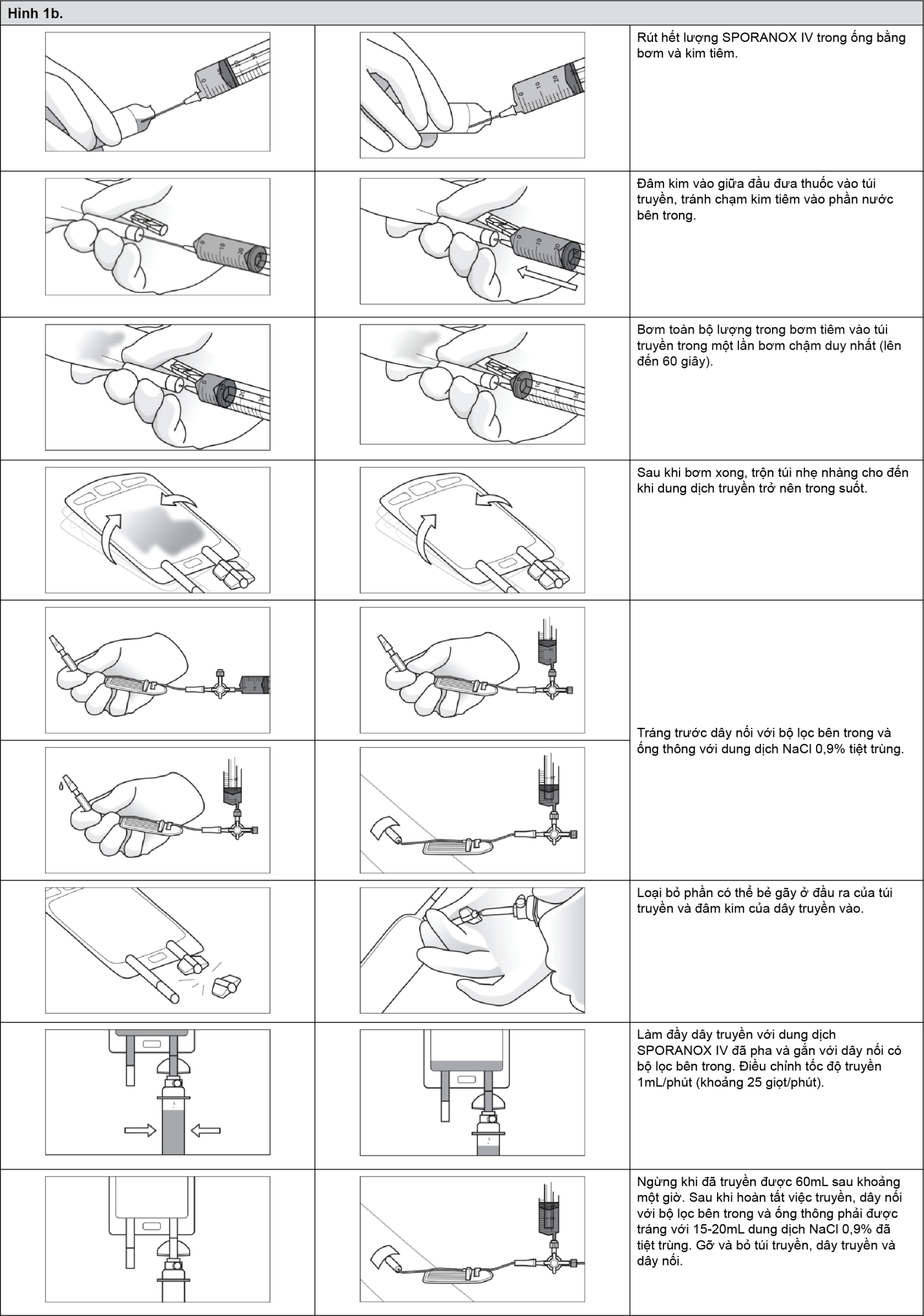

Liều dùng:
Sản phẩm này được cung cấp với dây nối có khóa van hai chiều và bộ lọc 0,2 μm bên trong. Dây nối được thiết kế chuyên biệt bao gồm bộ lọc bên trong phải được sử dụng để đảm bảo sản phẩm được sử dụng đúng (xem Hướng dẫn sử dụng).
SPORANOX IV được sử dụng trong hai ngày đầu với liều tấn công hai lần mỗi ngày, sau đó dùng liều một lần mỗi ngày.
Ngày điều trị thứ nhất và thứ hai: truyền trong 1 giờ 200 mg SPORANOX IV (60 mL dung dịch đã pha) hai lần mỗi ngày (xem Hướng dẫn sử dụng).
Từ ngày thứ ba trở đi: truyền trong 1 giờ 200 mg SPORANOX IV (60 mL dung dịch đã pha) mỗi ngày. Chưa xác định được độ an toàn khi điều trị dài hơn 14 ngày.
Đối với việc điều trị theo kinh nghiệm cho những bệnh nhân sốt giảm bạch cầu nghi ngờ nhiễm nấm toàn thân, điều trị nên được tiếp tục với dung dịch uống SPORANOX cho tới khi giải quyết được đáng kể tình trạng giảm bạch cầu trên lâm sàng. Để điều trị nhiễm Aspergillus, nhiễm Candida, nhiễm Cryptococcus (bao gồm viêm màng não do Cryptococcus) và nhiễm Histoplasma, nên duy trì điều trị với viên nang SPORAL.
Đối tượng đặc biệt
Trẻ em: Dữ liệu lâm sàng về việc sử dụng SPORANOX IV trên bệnh nhi còn hạn chế. Không khuyến cáo sử dụng SPORANOX IV cho bệnh nhi trừ khi xác định rằng lợi ích điều trị cao hơn các nguy cơ có thể xảy ra (xem Cảnh báo).
Người cao tuổi: Dữ liệu lâm sàng về việc sử dụng SPORANOX IV trên người cao tuổi còn hạn chế. Khuyên chỉ nên sử dụng SPORANOX IV trên những bệnh nhân này khi xác định rằng lợi ích điều trị cao hơn các nguy cơ có thể xảy ra. Nói chung, khuyến cáo nên cân nhắc khi chọn liều cho một bệnh nhân cao tuổi, phản ánh tần suất lớn hơn của giảm chức năng gan, thận hoặc tim, và bệnh đi kèm hoặc điều trị bằng thuốc khác (xem Cảnh báo).
Bệnh nhân suy gan: Dữ liệu sử dụng itraconazol trên bệnh nhân suy gan hiện có còn hạn chế. Nên thận trọng khi sử dụng thuốc ở nhóm bệnh nhân này (xem Dược động học Đối tượng đặc biệt, Suy gan).
Bệnh nhân suy thận: Dữ liệu sử dụng itraconazol đường tĩnh mạch trên bệnh nhân suy thận hiện có còn hạn chế.
Hydroxypropyl-β-cyclodextrin, một thành phần bắt buộc trong công thức bào chế của SPORANOX đường tĩnh mạch, được thải trừ qua lọc cầu thận. Vì vậy, chống chỉ định dùng SPORANOX IV trên những bệnh nhân suy thận được xác định có độ thanh thải creatinin dưới 30mL/phút (xem Chống chỉ định).
Trên những bệnh nhân suy thận mức độ nhẹ đến trung bình, phải thận trọng khi sử dụng SPORANOX IV. Nồng độ creatinin huyết thanh phải được theo dõi chặt chẽ và, nếu nghi ngờ có độc thận, thì nên cân nhắc đổi qua viên nang SPORAL (xem Cảnh báo và Dược động học).
4.3. Chống chỉ định:
Chống chỉ định SPORANOX IV trên những bệnh nhân đã biết quá mẫn với thuốc hay bất kỳ thành phần nào của thuốc.
Không thể dùng SPORANOX IV khi có chống chỉ định sử dụng Natri Clorid tiêm truyền.
Thành phần tá dược hydroxypropyl-β-cyclodextrin được thải trừ qua lọc cầu thận. Vì vậy chống chỉ định SPORANOX IV trên những bệnh nhân suy thận nặng (được xác định có độ thanh thải creatinin dưới 30mL/phút) (xem Liều lượng và Cách dùng, Cảnh báo và Dược động học).
Chống chỉ định dùng đồng thời một số thuốc được chuyển hóa bởi CYP3A4 với SPORANOX IV. Sự gia tăng nồng độ trong huyết thanh của các thuốc này do dùng đồng thời với itraconazol, có thể làm tăng hoặc kéo dài tác động điều trị và cả tác dụng bất lợi đến mức có thể xảy ra các tình huống nghiêm trọng tiềm tàng. Ví dụ, sự gia tăng nồng độ của một số thuốc này trong huyết thanh có thể dẫn đến kéo dài khoảng QT và nhịp nhanh thất bao gồm xảy ra xoắn đỉnh, một rối loạn nhịp tim có thể gây tử vong. Các ví dụ thuốc cụ thể được liệt kê trong mục Tương tác.
Không được sử dụng SPORANOX IV cho phụ nữ có thai (ngoại trừ những trường hợp đe dọa tính mạng) xem Sử dụng ở phụ nữ có thai và cho con bú.
Phụ nữ có khả năng mang thai nếu dùng SPORANOX IV phải sử dụng các biện pháp tránh thai. Nên tiếp tục sử dụng các biện pháp tránh thai hiệu quả sau khi kết thúc điều trị SPORANOX IV cho tới kỳ kinh kế tiếp.
4.4 Thận trọng:
Ảnh hưởng trên tim
Trong một nghiên cứu ở những người tình nguyện khỏe mạnh sử dụng SPORANOX IV, quan sát thấy có sự giảm thoáng qua không có triệu chứng của phân suất tống máu thất trái; hiện tượng này tự hết trước khi truyền liều tiếp theo.
Itraconazol cho thấy có hiệu ứng co bóp cơ tim âm và có các báo cáo suy tim sung huyết ở bệnh nhân dùng SPORANOX. Suy tim thường được báo cáo thường xuyên hơn trong số các báo cáo tự phát ở những bệnh nhân dùng liều tổng cộng 400 mg/ngày so với nhóm dùng tổng liều thấp hơn, gợi ý rằng nguy cơ suy tim có thể gia tăng theo với tổng liều hàng ngày của itraconazol.
Không nên dùng SPORANOX ở những bệnh nhân suy tim sung huyết hoặc tiền sử suy tim sung huyết trừ khi lợi ích điều trị cao hơn hẳn nguy cơ. Nên đánh giá cẩn thận những nguy cơ và lợi ích của việc điều trị bằng SPORANOX cho những bệnh nhân đã biết có những yếu tố nguy cơ của suy tim sung huyết. Những yếu tố nguy cơ này bao gồm bệnh tim như thiếu máu cục bộ và bệnh van tim; bệnh phổi nặng như bệnh phổi tắc nghẽn mạn tính; suy thận và các bệnh lý gây phù khác. Những bệnh nhân này phải được thông báo về những dấu hiệu và triệu chứng của suy tim sung huyết, nên được điều trị thận trọng, và nên được theo dõi chặt chẽ những dấu hiệu và triệu chứng của suy tim sung huyết trong thời gian điều trị. Phải ngừng sử dụng SPORANOX nếu xuất hiện những dấu hiệu và triệu chứng này.
Những thuốc chẹn kênh calci có thể có hiệu ứng co bóp cơ tim âm, nên có thể cộng hợp với hiệu ứng của itraconazol. Hơn nữa, itraconazol có thể ức chế sự chuyển hóa của các thuốc chẹn kênh calci. Do đó cần thận trọng khi sử dụng đồng thời itraconazol và thuốc chẹn kênh calci vì làm gia tăng nguy cơ suy tim sung huyết.
Khả năng tương tác thuốc: Dùng đồng thời một số thuốc chuyên biệt với itraconazol có thể dẫn đến những thay đổi hiệu quả của itraconazol và/hoặc thuốc phối hợp, đe dọa tính mạng và/hoặc đột tử. Các thuốc chống chỉ định, không được khuyến cáo hoặc được khuyên sử dụng thận trọng khi kết hợp với itraconazol được liệt kê ở mục Tương tác.
Mẫn cảm chéo: Không có thông tin liên quan đến mẫn cảm chéo giữa itraconazol và các thuốc kháng nấm thuộc nhóm azol khác. Cần thận trọng trong việc kê toa SPORANOX IV cho những bệnh nhân mẫn cảm với các thuốc thuộc nhóm azol khác.
Bệnh lý thần kinh: Nếu xảy ra bệnh lý thần kinh mà có thể quy cho SPORANOX IV, nên ngừng điều trị.
Mất thính lực: Mất thính lực thoáng qua hay vĩnh viễn đã được báo cáo ở những bệnh nhân điều trị với itraconazol. Một vài báo cáo trong số này bao gồm có sử dụng đồng thời với thuốc bị chống chỉ định là quinidin (xem Chống chỉ định và Tương tác Các thuốc có thể bị tăng nồng độ trong huyết tương do itraconazol). Mất thính lực thường hết khi ngừng thuốc, nhưng có thể kéo dài ở một số bệnh nhân.
Đề kháng chéo: Trong nhiễm Candida hệ thống, nếu nghi ngờ các chủng CandidaI đề kháng fluconazol, thì không thể cho rằng các chủng này nhạy cảm với itraconazol, vì vậy khuyến cáo nên kiểm tra tính nhạy cảm trước khi bắt đầu điều trị với itraconazol.
Ảnh hưởng trên gan
Rất hiếm các trường hợp độc tính gan nghiêm trọng, bao gồm vài trường hợp suy gan cấp gây tử vong, khi dùng SPORANOX. Hầu hết những trường hợp này có liên quan đến bệnh nhân có tiền sử bệnh gan, đã được điều trị cho các chỉ định nhiễm nấm toàn thân, có những bệnh lý y khoa quan trọng khác và/hoặc đã sử dụng kèm những thuốc khác có độc tính trên gan. Một vài bệnh nhân không có yếu tố nguy cơ rõ ràng về bệnh gan. Một số trường hợp được quan sát thấy trong tháng đầu điều trị, kể cả trong tuần điều trị đầu tiên. Nên cân nhắc việc theo dõi chức năng gan ở bệnh nhân điều trị với SPORANOX. Nên hướng dẫn cho bệnh nhân báo cáo ngay cho bác sỹ những dấu hiệu và triệu chứng gợi ý viêm gan như biếng ăn, buồn nôn, nôn, mệt mỏi, đau bụng hoặc nước tiểu sậm màu. Phải ngừng ngay việc điều trị ở những bệnh nhân này và theo dõi chức năng gan.
Các nghiên cứu đã không được thực hiện với itraconazol truyền tĩnh mạch ở bệnh nhân suy gan. Dữ liệu hiện có về việc sử dụng của itraconazol uống ở những bệnh nhân suy gan còn hạn chế. Cần thận trọng khi thuốc được dùng cho nhóm bệnh nhân này. Các bệnh nhân bị suy giảm chức năng gan được khuyến cáo theo dõi cẩn thận khi dùng itraconazol. Trong thử nghiệm lâm sàng đã quan sát thấy thời gian bán thải của itraconazol kéo dài sau khi uống liều duy nhất viên nang itraconazol trên bệnh nhân xơ gan, nên cần thận trọng khi quyết định bắt đầu điều trị với các thuốc khác được chuyển hóa bởi CYP3A4.
Điều trị với SPORANOX chắc chắn không được khuyến cáo ở những bệnh nhân có tăng hoặc bất thường men gan hoặc bệnh gan đang giai đoạn hoạt động, hoặc những người đã bị độc tính trên gan với các thuốc khác, trừ khi có một tình huống nghiêm trọng hoặc đe dọa tính mạng khi mà lợi ích điều trị cao hơn hẳn nguy cơ có thể xảy ra. Khuyến cáo nên theo dõi chức năng gan ở những bệnh nhân có bất thường chức năng gan trước đó hoặc những người đã từng bị độc tính gan với các thuốc khác (xem Liều lượng và Cách dùng và Dược động học – Đối tượng đặc biệt, Suy gan).
Trẻ em: Dữ liệu lâm sàng về việc dùng SPORANOX IV ở bệnh nhi còn hạn chế. Không khuyến cáo sử dụng SPORANOX IV ở bệnh nhi trừ khi xác định rằng lợi ích điều trị cao hơn nguy cơ có thể xảy ra.
Người cao tuổi: Dữ liệu lâm sàng về việc dùng SPORANOX IV ở người cao tuổi còn hạn chế. Khuyến cáo dùng SPORANOX IV ở những bệnh nhân này chỉ khi xác định rằng lợi ích điều trị cao hơn nguy cơ có thể xảy ra. Nói chung, khuyến cáo cân nhắc khi chọn liều cho một bệnh nhân lớn tuổi, vì bệnh nhân lớn tuổi luôn phản ánh tần suất lớn hơn của giảm chức năng gan, thận, hoặc tim, và bệnh đi kèm hoặc đang điều trị với thuốc khác.
Suy thận
Hydroxypropyl-β-cyclodextrin, khi dùng đường tĩnh mạch, thì sẽ bị thải qua lọc cầu thận. Vì vậy, chống chỉ định SPORANOX IV ở những bệnh nhân có suy thận nặng xác định bởi độ thanh thải creatinin dưới 30mL/phút (xem Chống chỉ định).
Thận trọng khi sử dụng SPORANOX IV ở những bệnh nhân có suy chức năng thận mức độ nhẹ (xác định bởi độ thanh thải creatinin 50-80mL/phút) hoặc trung bình (xác định bởi độ thanh thải creatinin 30-49mL/phút). Kiểm soát chặt chẽ nồng độ creatinin huyết thanh, nếu nghi ngờ có độc thận thì nên đổi qua SPORAL dạng viên nang.
Tác động của thuốc trên người lái xe và vận hành máy móc.
Không thực hiện nghiên cứu về ảnh hưởng trên khả năng lái xe và vận hành máy móc. Khi lái xe và vận hành máy móc, khả năng phản ứng bất lợi như chóng mặt, rối loạn thị giác và mất thính lực (xem Tác dụng ngoại ý) có thể xảy ra trong một số trường hợp nên phải lưu ý.
4.5 Sử dụng cho phụ nữ có thai và cho con bú:
Xếp hạng cảnh báo
AU TGA pregnancy category: B3
US FDA pregnancy category: C
Thời kỳ mang thai:
SPORANOX IV không được sử dụng trong thai kỳ ngoại trừ những trường hợp đe doạ tính mạng mà đã cân nhắc thấy lợi ích điều trị cho mẹ vượt trội nguy cơ có hại cho thai nhi (xem Chống chỉ định).
Nghiên cứu itraconazol trên động vật cho thấy độc tính trên sinh sản (xem An toàn tiền lâm sàng).
Các thông tin về sử dụng SPORANOX ở phụ nữ có thai còn hạn chế. Kinh nghiệm sử dụng sau khi đưa ra thị trường, đã có những báo cáo các trường hợp bất thường bẩm sinh. Các trường hợp này bao gồm dị tật xương, đường niệu sinh dục, tim mạch và nhãn khoa cũng như các dị tật về nhiễm sắc thể và đa dị tật. Vẫn chưa thiết lập được mối liên hệ nhân quả với việc sử dụng SPORANOX.
Dữ liệu dịch tễ học về việc sử dụng SPORANOX trong 3 tháng đầu thai kỳ đa phần là ở những bệnh nhân điều trị nấm candida âm đạoâm hộ với liều điều trị ngắn hạn, không thấy tăng thêm nguy cơ dị tật so với nhóm chứng, là những bệnh nhân không dùng bất kỳ thuốc nào có khả năng gây dị tật thai. Itraconazol được cho thấy có qua nhau thai ở mô hình thử nghiệm trên chuột cống.
Phụ nữ có khả năng mang thai:
Phụ nữ có khả năng mang thai khi dùng thuốc SPORANOX IV nên sử dụng các biện pháp tránh thai. Nên tiếp tục sử dụng các biện pháp ngừa thai hiệu quả sau khi ngừng điều trị SPORANOX IV cho tới chu kỳ kinh nguyệt kế tiếp.
Thời kỳ cho con bú:
Chỉ một lượng rất nhỏ itraconazol được bài tiết vào trong sữa mẹ. Vì vậy, nên cân nhắc lợi ích điều trị bằng SPORANOX IV với nguy cơ có thể có khi cho con bú. Trong trường hợp nghi ngờ, bệnh nhân không nên cho con bú.
Khả năng sinh sản:
Tham khảo An toàn tiền lâm sàng về khả năng sinh sản trên động vật liên quan đến itraconazol và hydroxypropyl-β-cyclodextrin.
4.6 Tác dụng không mong muốn (ADR):
Phần này trình bày những phản ứng bất lợi. Phản ứng bất lợi là những biến cố bất lợi được xem như phần nào có liên quan tới việc sử dụng itraconazol dựa trên đánh giá toàn diện thông tin biến cố bất lợi có sẵn. Mối liên hệ nhân quả với itraconazol không thể xác định một cách chắc chắn từ các trường hợp riêng lẻ. Hơn nữa, bởi vì các thử nghiệm lâm sàng được tiến hành trong các điều kiện khác nhau, tỷ lệ phản ứng bất lợi quan sát được ở các thử nghiệm lâm sàng của một thuốc không thể so sánh trực tiếp với tỷ lệ của các thử nghiệm lâm sàng của thuốc khác và không thể phản ánh tỷ lệ trong thực hành lâm sàng.
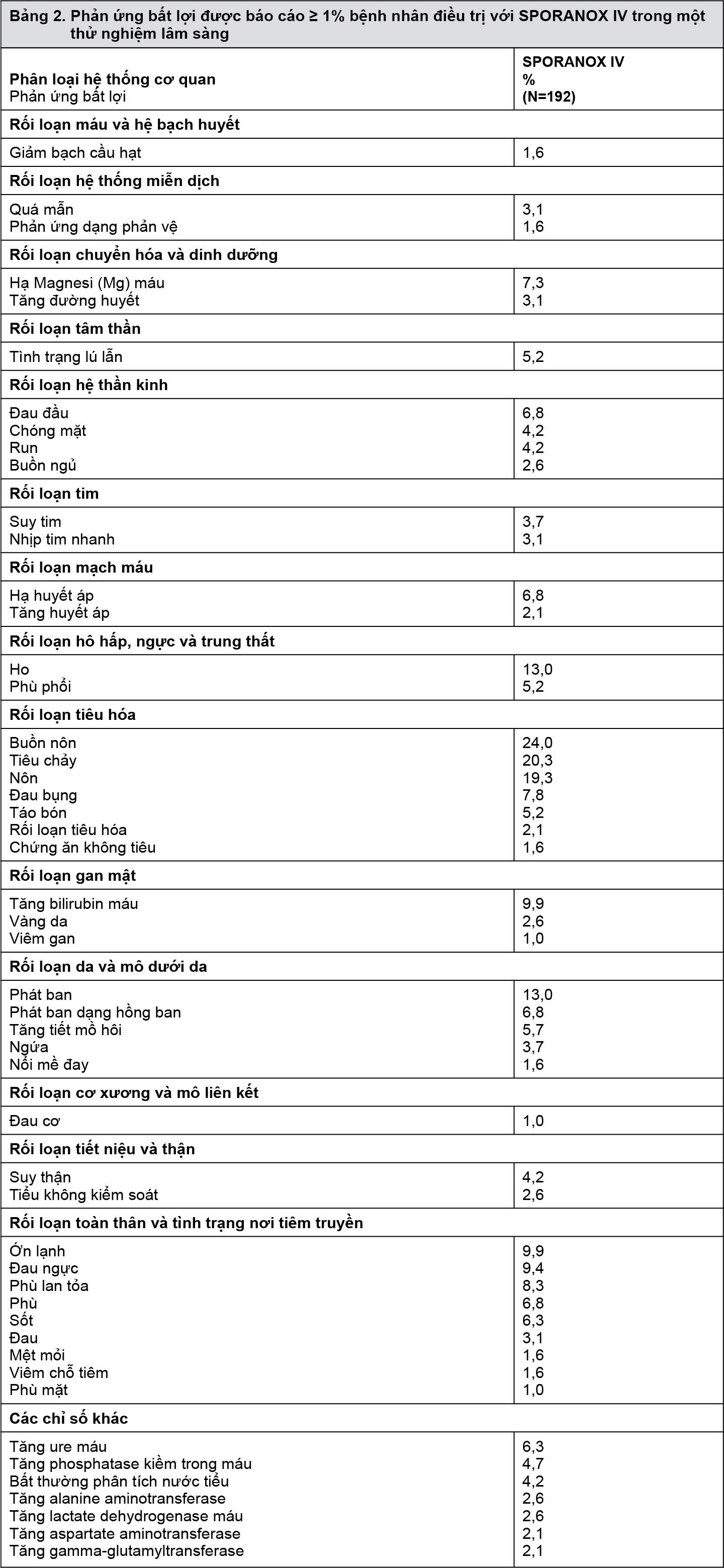
Dữ liệu thử nghiệm lâm sàng: Tính an toàn của SPORANOX IV đã được đánh giá trên 192 bệnh nhân tham gia trong một thử nghiệm lâm sàng ngẫu nhiên, có đối chứng, nhãn mở cho điều trị theo kinh nghiệm của các bệnh nhân sốt giảm bạch cầu trung tính. Những bệnh nhân này được tiêm ít nhất một liều SPORANOX IV và cung cấp dữ liệu an toàn. Phản ứng bất lợi được báo cáo ≥1% bệnh nhân điều trị với SPORANOX IV trong thử nghiệm lâm sàng này được thể hiện trong Bảng 2.
– xem Bảng 2.

Phản ứng bất lợi xảy ra <1% bệnh nhân điều trị với SPORANOX IV trong thử nghiệm lâm sàng này được liệt kê ở Bảng 3.
– xem Bảng 3.


Sau đây là danh sách các phản ứng bất lợi thêm vào có liên quan với itraconazol đã được báo cáo trong các thử nghiệm lâm sàng của dung dịch uống SPORANOX và/hoặc viên nang SPORAL.
Nhiễm trùng và nhiễm ký sinh trùng: Viêm xoang, nhiễm trùng đường hô hấp trên, viêm mũi.
Rối loạn máu và hệ bạch huyết: Giảm bạch cầu.
Rối loạn chuyển hóa và dinh dưỡng: Hạ kali máu.
Rối loạn hệ thống thần kinh: Bệnh lý thần kinh ngoại vi, dị cảm.
Rối loạn tai và mê đạo: Ù tai.
Rối loạn tiêu hóa: Đầy hơi.
Rối loạn gan mật: Suy gan, chức năng gan bất thường.
Rối loạn cơ xương và mô liên kết: Đau khớp.
Rối loạn thận và tiết niệu: Tiểu lắt nhắt.
Rối loạn hệ thống sinh sản và vú: Rối loạn cương dương, rối loạn kinh nguyệt.
Trẻ em
Tính an toàn của SPORANOX IV đã được đánh giá ở 36 bệnh nhi từ 6 tháng đến 17 tuổi tham gia trong 3 thử nghiệm lâm sàng nhãn mở. Những bệnh nhân này đã được tiêm truyền ít nhất một liều SPORANOX IV để phòng ngừa hoặc điều trị nhiễm nấm và đã cung cấp dữ liệu an toàn.
Dựa trên dữ liệu gộp về tính an toàn từ những thử nghiệm lâm sàng này, các phản ứng bất lợi trên bệnh nhi được báo cáo rất phổ biến là sốt (16,7%) và nôn (11,1%). Bản chất của phản ứng bất lợi ở bệnh nhi là tương tự như quan sát thấy ở người lớn, nhưng nói chung, tỉ lệ mắc cao hơn trong các đối tượng người lớn.
Dữ liệu sau khi đưa ra thị trường
Ngoài các phản ứng bất lợi được báo cáo trong các nghiên cứu lâm sàng và các phản ứng bất lợi được kể trên, các phản ứng bất lợi sau đã được báo cáo trong quá trình đưa thuốc ra thị trường (Bảng 4). Trong bảng này, các tần số được cung cấp theo quy ước sau đây:
Rất thường gặp ≥1/10
Thường gặp ≥1/100 và <1/10
Ít gặp ≥1/1000 và <1/100
Hiếm gặp ≥1/10000 và <1/1000
Rất hiếm gặp <1/10000, bao gồm cả những báo cáo riêng biệt.
Trong Bảng 4, các phản ứng bất lợi được trình bày theo tần số dựa theo tỷ lệ báo cáo tự phát.
– xem Bảng 4.


Thông báo cho Bác sĩ những tác dụng không mong muốn gặp phải khi sử dụng thuốc.
4.7 Hướng dẫn cách xử trí ADR:
Ngừng sử dụng thuốc. Với các phản ứng bất lợi nhẹ, thường chỉ cần ngừng thuốc. Trường hợp mẫn cảm nặng hoặc phản ứng dị ứng, cần tiến hành điều trị hỗ trợ (giữ thoáng khí và dùng epinephrin, thở oxygen, dùng kháng histamin, corticoid…).
4.8 Tương tác với các thuốc khác:
Itraconazol là một thuốc có khả năng tương tác cao. Các loại tương tác khác nhau và các khuyến cáo chung có liên quan được mô tả ở dưới đây. Ngoài ra, một bảng được cung cấp để liệt kê các ví dụ về thuốc có thể tương tác với itraconazol, được sắp xếp theo nhóm thuốc để dễ dàng tham khảo. Danh sách các ví dụ này chưa đầy đủ và do đó nên tham khảo nhãn của mỗi thuốc được dùng cùng với itraconazol để biết thêm thông tin liên quan về đường chuyển hóa, tương tác, nguy cơ tiềm ẩn, và các thông tin cụ thể khi dùng đồng thời.
Itraconazol được chuyển hóa chủ yếu bởi CYP3A4. Các chất khác có chung đường chuyển hóa này hoặc làm thay đổi hoạt tính CYP3A4 có thể ảnh hưởng đến dược động học của itraconazol. Dùng đồng thời itraconazol với các chất gây cảm ứng CYP3A4 mạnh và trung bình có thể làm giảm sinh khả dụng của itraconazol và hydroxy-itraconazol đến mức hiệu quả của itraconazol có thể bị giảm. Dùng đồng thời với các chất ức chế CYP3A4 mạnh và trung bình có thể làm tăng sinh khả dụng của itraconazol, điều này có thể làm tăng hoặc kéo dài tác dụng dược lý của itraconazol.
Itraconazol và chất chuyển hóa chính của nó, hydroxy-itraconazol là các chất ức chế CYP3A4 mạnh. Itraconazol là một chất ức chế vận chuyển thuốc bởi P-glycoprotein và protein ức chế ung thư vú (BCRP). Itraconazol có thể ức chế chuyển hóa của các thuốc được chuyển hóa bởi CYP3A4 và có thể ức chế vận chuyển thuốc bởi P-glycoprotein và/hoặc BCRP, điều này có thể dẫn đến tăng nồng độ trong huyết tương của các thuốc này và/hoặc các chất chuyển hóa có hoạt tính của các thuốc này khi chúng được dùng cùng với itraconazol. Sự tăng nồng độ trong huyết tương này có thể tăng hoặc kéo dài cả tác dụng điều trị và không mong muốn của các thuốc này. Đối với một số thuốc, dùng cùng với itraconazol có thể dẫn đến giảm nồng độ trong huyết tương của thuốc hoặc của phần phân tử có hoạt tính của thuốc. Điều này có thể làm giảm hiệu quả của thuốc.
Sau khi ngừng điều trị với itraconazol, các nồng độ thuốc trong huyết tương giảm dưới giới hạn có thể phát hiện được trong 7 đến 14 ngày, phụ thuộc vào liều và thời gian điều trị. Trên các bệnh nhân xơ gan hoặc các đối tượng dùng các thuốc ức chế CYP3A4, nồng độ trong huyết tương giảm chậm hơn. Điều này đặc biệt quan trọng khi xem xét bắt đầu điều trị với các thuốc mà chuyển hóa của nó bị ảnh hưởng bởi itraconazol.
Áp dụng các khuyến cáo chung sau đây, trừ khi có khuyến cáo khác với trong bảng:
“Chống chỉ định”: Là loại thuốc không được dùng đồng thời với itraconazol trong mọi trường hợp. Điều này áp dụng cho:
Các cơ chất của CYP3A4 mà có nồng độ trong huyết tương bị tăng có thể làm tăng hoặc kéo dài tác dụng điều trị và/hoặc tác dụng không mong muốn đến mức có thể xảy ra các trường hợp nghiêm trọng. (xem Chống chỉ định).
“Không khuyến cáo”: Nên tránh sử dụng thuốc, trừ khi lợi ích vượt trội khả năng gia tăng nguy cơ. Nếu không thể tránh việc dùng đồng thời, khuyến cáo theo dõi lâm sàng, và dường như cần thiết điều chỉnh liều itraconazol và/hoặc các thuốc dùng đồng thời. Khi có điều kiện thích hợp, khuyến cáo nên đo nồng độ trong huyết tương. Điều này áp dụng cho:
Chất gây cảm ứng CYP3A4 mạnh và trung bình: không khuyến cáo từ 2 tuần trước và trong quá trình điều trị với itraconazol.
Các cơ chất của CYP3A4/P-gp/BCRP mà có nồng độ bị tăng hoặc giảm trong huyết tương dẫn đến nguy cơ quan trọng: không khuyến cáo trong và sau 2 tuần điều trị với itraconazol.
“Sử dụng thận trọng”: khuyến cáo theo dõi cẩn thận khi dùng thuốc đồng thời với itraconazol. Khi dùng chung, các bệnh nhân được khuyến cáo theo dõi chặt chẽ và dường như là cần thiết điều chỉnh liều của itraconazol và/hoặc thuốc dùng phối hợp. Khi thích hợp, khuyến cáo đo nồng độ trong huyết tương. Điều này áp dụng cho:
Chất ức chế CYP3A4 mạnh và trung bình.
Các cơ chất của CYP3A4/P-gp/BCRP mà có nồng độ bị tăng hoặc giảm trong huyết tương dẫn đến nguy cơ liên quan trên lâm sàng.
Ví dụ về các thuốc tương tác được liệt kê trong bảng dưới đây. Các thuốc được liệt kê trong bảng này dựa trên hoặc các nghiên cứu tương tác thuốc hoặc các ca báo cáo, hoặc các tương tác tiềm tàng dựa trên cơ chế của loại tương tác:
xem Bảng 1a, b, c, d ,e ,f.








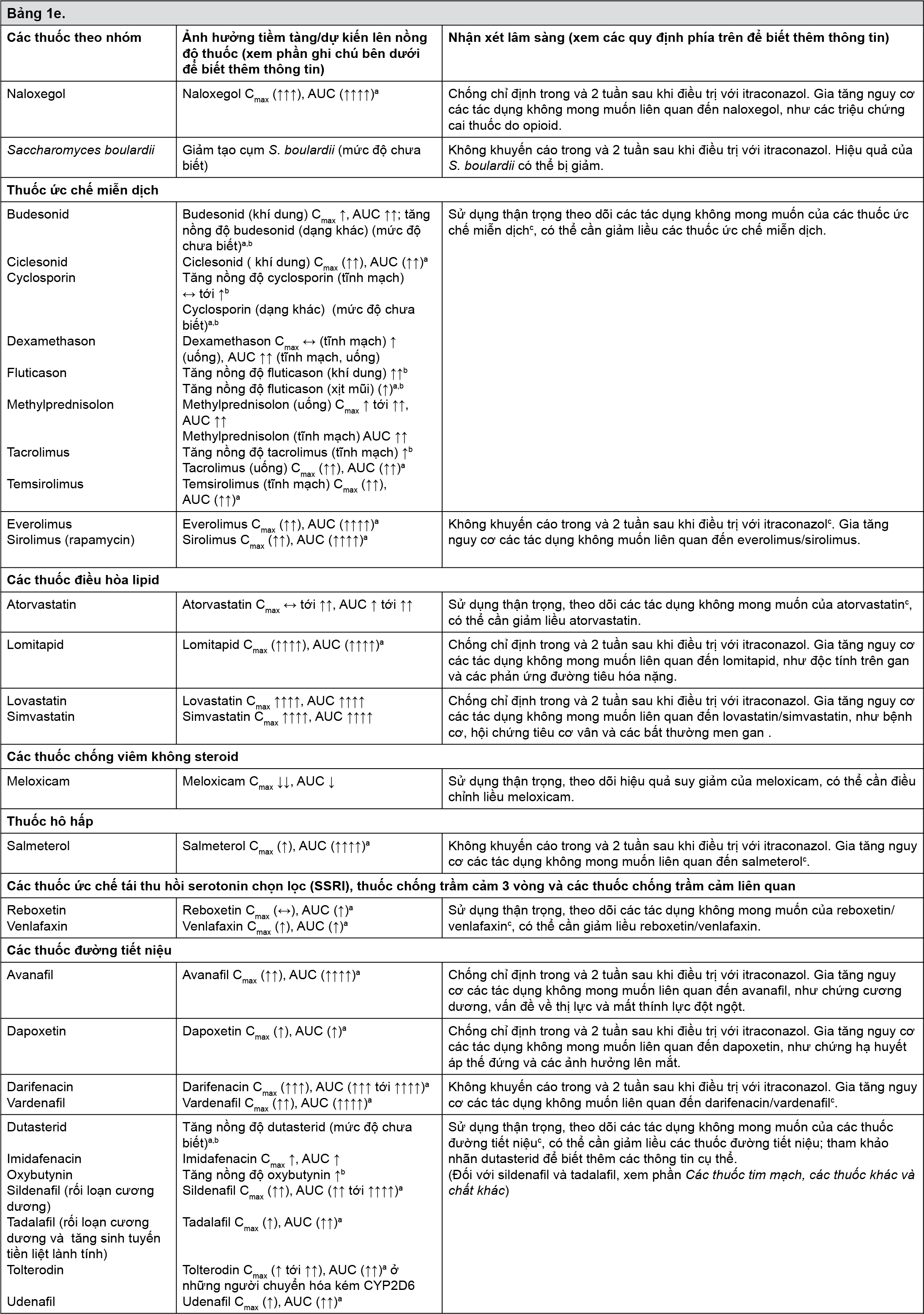

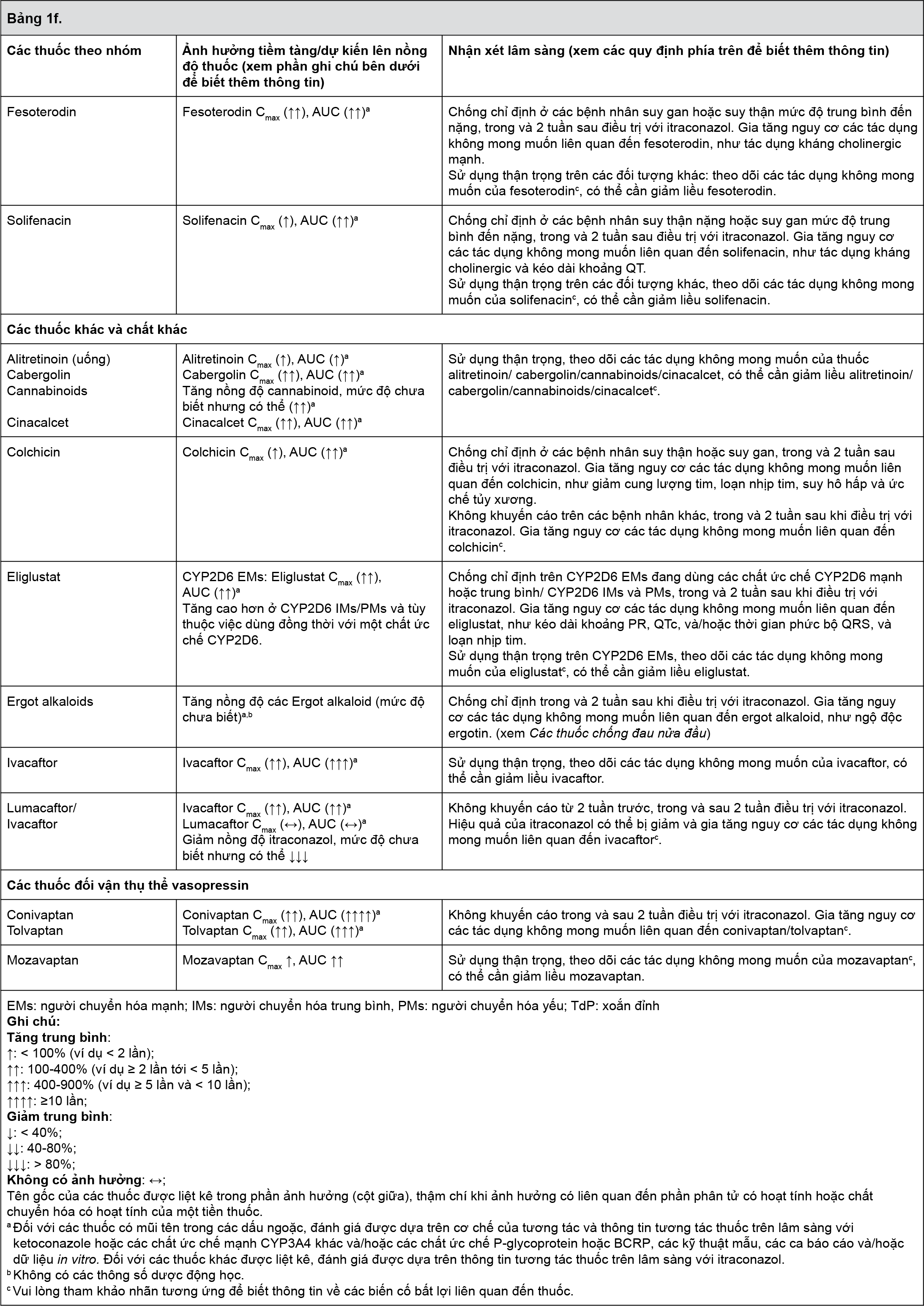

Đối tượng trẻ em: Các nghiên cứu tương tác chỉ được thực hiện ở người lớn.
4.9 Quá liều và xử trí:
Triệu chứng và dấu hiệu: Nói chung, những biến cố bất lợi được báo cáo về quá liều phù hợp với những biến cố được báo cáo khi sử dụng itraconazol (xem Tác dụng ngoại ý).
Điều trị: Trong trường hợp quá liều, nên áp dụng các biện pháp hỗ trợ. Itraconazol không thể được loại bỏ bằng lọc thận. Không có thuốc đối kháng đặc hiệu.
5. Cơ chế tác dụng của thuốc :
5.1. Dược lực học:
Mối quan hệ Dược động học (PK)/Dược lực học (PD): Mối quan hệ PK/PD của itraconazol, và nhóm triazoles nói chung ít được hiểu rõ.
Tác dụng dược lực học
Vi sinh
Itraconazol, một dẫn xuất triazol, có phổ kháng nấm rộng.
Đối với itraconazol, điểm thiết lập độ nhạy với thuốc (breakpoint) chỉ được thiết lập bởi CLSI cho Candida spp. Từ các loại nhiễm nấm nông (CLSI M27-A2). Điểm breakpoint theo CLSI như sau: nhạy cảm ≤0,125; nhạy cảm, phụ thuộc liều 0,25-0,5 và đề kháng ≥1µg/mL. Các điểm breakpoint có thể diễn dịch đã không được thiết lập theo CLSI cho nấm sợi.
Điểm breakpoint theo EUCAST cho itraconazol đã được thiết lập cho Aspergillus flavus, A. fumigatus, A. nidulans và A. terreus, như sau: nhạy cảm ≤1 mg/L, đề kháng >2 mg/L. Điểm breakpoint theo EUCAST chưa được thiết lập cho itraconazol và Candida spp.
Các nghiên cứu in vitro cho thấy itraconazol ức chế sự phát triển của nhiều loại vi nấm gây bệnh cho người ở nồng độ thông thường ≤1 μg/mL. Các vi nấm này bao gồm: Candida spp. (bao gồm Candida albicans, Candida tropicalis, Candida parapsilosis, và Candida dubliniensis), Aspergillus spp., Blastomyces dermatitidis, Cladosporium spp., Coccidioides immitis, Cryptococcus neoformans, Geotrichum spp., Histoplasma spp., bao gồm H. capsulatum, Paracoccidioides brasiliensis, Penicillium marneffei, Sporothrix schenckii và Trichosporon spp. Trên thử nghiệm in vitro, itraconazol cũng có hoạt tính đối với Epidermophyton floccosum, Fonsecaea spp., Malassezia spp., Microsporum spp., Pseudallescheria boydii, Trichophyton spp. và các loại nấm men và vi nấm khác. Candida krusei, Candida glabrata và Candida guillermondii thường là các chủng Candida kém nhạy cảm nhất, ở vài thử nghiệm phân lập trong ống nghiệm cho thấy chúng đề kháng với itraconazol.
Các loại vi nấm chính không bị ức chế bởi itraconazol là Zygomycetes (Rhizopus spp., Rhizomucor spp., Mucor spp. và Absidia spp.), Fusarium spp., Scedosporium spp. và Scopulariopsis spp.
Sự đề kháng azol có vẻ hình thành chậm và thường là kết quả của vài đột biến gen. Các cơ chế được mô tả như là sự biểu hiện quá mức của ERG11 làm mã hóa men đích 14α-demethylase, các đột biến điểm trong ERG11 dẫn đến giảm ái lực với đích và/hoặc sự biểu hiện quá mức của chất vận chuyển dẫn đến tăng bơm ra ngoài. Đề kháng chéo giữa các azol đã được quan sát thấy ở Candida spp., mặc dù sự đề kháng của một thuốc trong nhóm không nhất thiết có nghĩa là đề kháng với các azol khác. Chủng nấm Aspergillus fumigatus đã được báo cáo có đề kháng với itraconazol.
Cơ chế tác dụng:
Các nghiên cứu in vitro cho thấy itraconazol làm giảm sự tổng hợp ergosterol trong tế bào vi nấm. Ergosterol là thành phần thiết yếu của màng tế bào vi nấm. Sự suy giảm tổng hợp này tạo nên hiệu quả kháng nấm.
[XEM TẠI ĐÂY]
5.2. Dược động học:
Các tính chất dược động học chung
Nồng độ đỉnh trong huyết tương của itraconazol đạt được tại thời điểm kết thúc truyền tĩnh mạch, giảm xuống sau đó. Nồng độ đỉnh trong huyết tương của hydroxy-itraconazol (xem ”Chuyển hóa” phía dưới) đạt được trong khoảng 3 giờ sau khi bắt đầu truyền trong 1 giờ, giảm xuống sau đó. Như một hệ quả của đặc tính động học không tuyến tính, itraconazol tích lũy trong huyết tương khi sử dụng đa liều.
Trong 4 nghiên cứu dược động học đa liều trên bệnh nhân, itraconazol IV được truyền tĩnh mạch trong 1 giờ với liều 200 mg hai lần/ngày ở ngày điều trị thứ nhất và thứ hai, sau đó truyền 200 mg một lần/ngày từ ngày thứ 3 đến thứ 7. Nồng độ hằng định trong huyết tương của itraconazol và hydroxy-itraconazol thường đạt được tương ứng trong khoảng 48 và 96 giờ. Nồng độ trong huyết tương của itraconazol đạt được > 250ng/mL ở hầu hết các bệnh nhân.
Độ thanh thải toàn bộ trung bình của itraconazol sau khi dùng đường tĩnh mạch là 278mL/phút. Độ thanh thải của itraconazol giảm đi ở những liều cao hơn do chuyển hóa ở gan bị bão hòa. Thời gian bán hủy cuối cùng của itraconazol thường trong khoảng từ 16 đến 28 giờ sau khi sử dụng đơn liều và tăng lên 34 đến 42 giờ sau khi sử dụng liều lặp lại.
Mỗi liều itraconazol 200 mg truyền tĩnh mạch chứa 8 g hydroxypropyl-β-cyclodextrin để làm tăng độ hòa tan của itraconazol. Đặc tính dược động học của thành phần này được mô tả bên dưới (xem Dược động học Hydroxypropyl-β-Cyclodextrin).
Phân bố: Hầu hết itraconazol trong huyết tương kết hợp với protein (99,8%) mà albumin là thành phần gắn kết chính (99,6% cho chất chuyển hóa hydroxy). Nó cũng có ái lực mạnh với lipid. Chỉ có 0,2% itraconazol là tồn tại dưới dạng thuốc tự do trong huyết tương. Itraconazol được phân bố với thể tích biểu kiến lớn trong cơ thể (>700 L), cho thấy khả năng phân bố nhiều đến các mô. Nồng độ ở mô phổi, thận, gan, xương, dạ dày, lách và cơ, được ghi nhận cao hơn gấp 2-3 lần nồng độ tương ứng ở huyết tương, và sự thâm nhập của thuốc vào các tổ chức sừng, đặc biệt là da cao hơn đến 4 lần trong huyết tương. Nồng độ trong dịch não tủy thấp hơn nhiều trong huyết tương, nhưng hiệu quả chống nhiễm khuẩn có ở dịch não tủy đã được chứng minh.
Chuyển hóa: Itraconazol được chuyển hóa mạnh ở gan thành nhiều chất chuyển hóa. Các nghiên cứu in vitro cho thấy CYP 3A4 là men chính liên quan đến sự chuyển hóa của itraconazol. Chất chuyển hóa chính là hydroxy-itraconazol có hoạt tính kháng nấm in vitro tương đương itraconazol; nồng độ đáy trong huyết tương của chất chuyển hóa này gấp khoảng 2 lần itraconazol.
Thải trừ: Itraconazol được thải trừ chủ yếu dưới dạng chất chuyển hóa không hoạt tính trong nước tiểu (35%) và trong phân (54%) trong vòng một tuần sau một liều dung dịch uống. Sự thải trừ qua thận của itraconazol và chất chuyển hóa có hoạt tính hydroxy-itraconazol thấp hơn 1% so với liều tiêm truyền tĩnh mạch. Dựa trên một liều thuốc đánh dấu phóng xạ đường uống, sự thải trừ qua phân của thuốc không chuyển hóa nằm trong khoảng từ 3% đến 18% liều dùng.
Bởi vì sự tái phân bố của itraconazol từ các mô sừng dường như không đáng kể, sự thải trừ của itraconazol từ những mô này liên quan đến sự tái sinh biểu bì. Trái với huyết tương, nồng độ thuốc trong da vẫn còn tồn tại từ 2 đến 4 tuần sau khi ngừng một đợt điều trị 4 tuần và trong sừng móng nơi mà itraconazol có thể được phát hiện sớm 1 tuần sau khi bắt đầu điều trị và tồn tại kéo dài ít nhất 6 tháng sau khi kết thúc một đợt điều trị 3 tháng.
Đối tượng đặc biệt
Suy gan: Không có nghiên cứu nào được thực hiện với itraconazol tĩnh mạch ở những bệnh nhân suy gan. Itraconazol chủ yếu được chuyển hóa ở gan. Một nghiên cứu về dược động học đã được tiến hành trên 6 người khỏe mạnh và 12 bệnh nhân xơ gan cho uống liều duy nhất 100 mg itraconazol dạng viên nang. Cmax trung bình giảm đáng kể (47%) có ý nghĩa thống kê và thời gian bán thải tăng hai lần (37±17 giờ so với 16±5 giờ) đã được ghi nhận ở người xơ gan so với người khỏe mạnh. Tuy nhiên, dựa trên AUC, nồng độ trong máu chung của itraconazol là như nhau ở nhóm xơ gan và nhóm khỏe mạnh. Không có dữ liệu về việc dùng itraconazol lâu dài ở nhóm xơ gan (xem Liều lượng và Cách dùng và Cảnh báo).
Suy thận: Một phần nhỏ (<1%) của một liều itraconazol đường tĩnh mạch được bài tiết không đổi qua nước tiểu.
Sau khi dùng liều đơn tĩnh mạch, thời gian bán hủy cuối cùng trung bình của itraconazol ở những bệnh nhân suy thận nhẹ (được xác định trong nghiên cứu này là có CrCL 50-79mL/phút), trung bình (được xác định trong nghiên cứu này là có CrCL 20-49mL/phút) và suy thận nặng (được xác định trong nghiên cứu này là có CrCl <20mL/phút) là tương tự như ở những người khỏe mạnh (khoảng trung bình lần lượt 42-49 giờ ở những bệnh nhân suy thận và 48 giờ ở người khỏe mạnh). Nồng độ phơi nhiễm chung của itraconazol, dựa trên AUC, giảm ở những bệnh nhân suy thận trung bình khoảng 30% và suy thận nặng khoảng 40% so với những người có chức năng thận bình thường.
Chưa có dữ liệu ở những bệnh nhân suy thận điều trị lâu dài với itraconazol. Thẩm phân máu không có tác động trên thời gian bán hủy hay thanh thải itraconazol hoặc hydroxy-itraconazol (xem thêm Liều lượng và Cách dùng, Chống chỉ định và Cảnh báo).
Trẻ em: Nghiên cứu dược động học khi sử dụng itraconazol trên nhóm bệnh nhi còn hạn chế. Những nghiên cứu dược động học lâm sàng ở trẻ em và thanh thiếu niên ở độ tuổi từ 5 tháng đến 17 tuổi tiến hành với itraconazol viên nang, dung dịch uống và đường tĩnh mạch. Liều cho mỗi bệnh nhân dùng viên nang và dung dịch uống là từ 1,5 đến 12,5 mg/kg/ngày, 1 hoặc 2 lần/ngày. Dạng dùng tĩnh mạch được truyền liều duy nhất 2,5 mg/kg hoặc 2,5 mg/kg truyền 1 hoặc 2 lần mỗi ngày. Đối với liều hàng ngày giống nhau, liều hai lần/ngày so với liều một lần/ngày cho nồng độ đáy và nồng độ đỉnh tương đương với người lớn dùng một liều hàng ngày. Không thấy có sự phụ thuộc đáng kể vào lứa tuổi đối với AUC và tổng lượng thanh thải toàn cơ thể của itraconazol, trong khi ghi nhận được sự liên hệ mờ nhạt giữa tuổi và thể tích phân bố itraconazol, Cmax và tốc độ thải trừ tận. Độ thanh thải biểu kiến và thể tích phân bố của itraconazol dường như liên quan đến trọng lượng cơ thể.
Hydroxypropyl-β-Cyclodextrin: Ở những bệnh nhân có chức năng thận bình thường, dữ liệu dược động học của hydroxypropyl-β-cyclodextrin, một thành phần của dạng bào chế SPORANOX đường tĩnh mạch, có thời gian bán hủy ngắn 1 đến 2 giờ, và cho thấy không có sự tích lũy sau các liều liên tiếp hàng ngày. Ở những người khỏe mạnh và ở những bệnh nhân có suy giảm chức năng thận từ nhẹ tới nặng, phần lớn (>85%) của liều 8 g hydroxypropyl-β-cyclodextrin được thải trừ trong nước tiểu. Sau một liều tĩnh mạch đơn itraconazol 200 mg, sự thanh thải của hydroxypropyl-β-cyclodextrin bị giảm ở những người suy thận, kết quả là nồng độ hydroxypropyl-β-cyclodextrin trong máu sẽ cao hơn. Ở những người có chức năng thận giảm nhẹ, trung bình hay nặng, thì thời gian bán hủy của thuốc sẽ cao hơn so với giá trị bình thường lần lượt khoảng hai, bốn hay sáu lần. Ở những bệnh nhân này, việc truyền liên tục có thể dẫn đến tích tụ hydroxypropyl-β-cyclodextrin cho tới khi đạt tới tình trạng hằng định. Hydroxypropyl-β-cyclodextrin bị thải bởi thẩm phân máu.
5.3 Giải thích:
Chưa có thông tin. Đang cập nhật.
5.4 Thay thế thuốc :
Chưa có thông tin. Đang cập nhật.
*Lưu ý:
Các thông tin về thuốc trên Pharmog.com chỉ mang tính chất tham khảo Khi dùng thuốc cần tuyệt đối tuân theo theo hướng dẫn của Bác sĩ
Chúng tôi không chịu trách nhiệm về bất cứ hậu quả nào xảy ra do tự ý dùng thuốc dựa theo các thông tin trên Pharmog.com
6. Phần thông tin kèm theo của thuốc:
6.1. Danh mục tá dược:
Hydroxypropyl-β-cyclodextrin, Propylene glycol, Hydrochloric acid concentrated, Sodium hydroxide (for pH adjustment), Water for injections, 0.9% Sodium Chloride Injection, Sodium Chloride, Water for Injections
6.2. Tương kỵ :
SPORANOX IV chỉ được pha với 50mL dung môi pha tiêm Natri Clorid 0,9%, được cung cấp kèm theo thuốc.
Dung môi pha tiêm Natri Clorid 0,9% tương thích với nhiều loại thuốc, bao gồm SPORANOX IV.
Itraconazol có xu hướng kết tủa khi hòa tan SPORANOX IV trong dung môi khác ngoài 50mL dung môi Natri Clorid 0,9% được cung cấp.
6.3. Bảo quản:
Ống tiêm SPORANOX IV: Bảo quản ở nhiệt độ không quá 30oC. Giữ ống tiêm trong hộp carton.
Dung môi pha tiêm Natri Clorid 0,9%: Bảo quản ở nhiệt độ không quá 30oC. Không để đông lạnh.
Dung dịch thuốc sau khi pha: Tránh tiếp xúc trực tiếp với ánh sáng mặt trời. Theo quan điểm vi sinh học, thì thuốc sau khi pha nên được sử dụng ngay lập tức. Nếu không được sử dụng ngay, thì thời gian bảo quản để sử dụng và các điều kiện bảo quản trước khi sử dụng là trách nhiệm của người dùng và thường không được kéo dài quá 24 giờ ở nhiệt độ từ 2oC tới 8oC, trừ khi các thao tác pha thuốc được thực hiện trong các điều kiện vô trùng đã được thẩm định và kiểm soát.
6.4. Thông tin khác :
An toàn tiền lâm sàng
Itraconazol đã trải qua bộ thử nghiệm chuẩn về các nghiên cứu an toàn tiền lâm sàng.
Những nghiên cứu độc tính cấp với itraconazol trên chuột nhắt, chuột cống, chuột lang và chó cho thấy giới hạn an toàn rộng. Những nghiên cứu độc tính mạn đường uống trên chuột cống và trên chó cho thấy độc tính mạn ở nhiều cơ quan hoặc mô đích như: vỏ thượng thận, gan và hệ đại thực bào đơn nhân cũng như các rối loạn chuyển hóa lipid thể hiện bằng những tế bào xanthoma trong nhiều cơ quan khác nhau.
Ở liều cao, khảo sát mô học của vỏ thượng thận cho thấy sự phù nề có thể hồi phục với sự phì đại tế bào của vùng lưới và vùng bó của vỏ thượng thận, thỉnh thoảng kèm với sự mỏng đi ở vùng tiểu cầu. Sự thay đổi ở gan có thể hồi phục được thấy ở liều cao. Sự thay đổi nhẹ được thấy trong các tế bào xoang gan và tạo không bào của tế bào gan, tạo không bào cho thấy rối loạn chức năng tế bào, nhưng không có biểu hiện viêm gan hay hoại tử tế bào gan. Sự thay đổi mô học của hệ thống thực bào đơn nhân được đặc trưng chính bởi đại thực bào với sự tăng những chất tương tự protein trong nhiều mô nhu mô.
Mật độ khoáng trong xương ở toàn cơ thể thấp hơn ở chó chưa trưởng thành sau khi dùng itraconazol kéo dài.
Trong 3 nghiên cứu độc tính trên chuột cống, itraconazol gây các khiếm khuyết ở xương. Các khiếm khuyết gây ra gồm giảm hoạt động của xương dẹt, làm mỏng vùng đặc của các xương lớn và dòn xương tăng lên.
Khả năng gây ung thư và đột biến gen
Itraconazol không phải là một chất có khả năng gây ung thư nguyên phát trên chuột nhắt hay chuột cống. Tuy nhiên trên chuột đực, có tần suất sarcom mô mềm cao hơn, có thể do tăng các phản ứng viêm mạn, không ác tính của mô liên kết như là một hệ quả của mức tăng cholesterol và lắng đọng cholesterol trong mô liên kết.
Không có dấu hiệu nào cho thấy itraconazol có khả năng gây đột biến gen.
Độc tính trên sinh sản: Itraconazol được cho là gây tăng có liên quan liều độc tính trên mẹ, độc tính cho phôi thai và gây dị tật thai trên chuột cống và chuột nhắt ở liều cao. Trên chuột cống, dị tật thai bao gồm những khiếm khuyết hệ xương chính; trên chuột nhắt dị tật thai bao gồm thoát vị não và phì đại lưỡi.
Khả năng sinh sản: Không có bằng chứng cho thấy ảnh hưởng chính trên sự sinh sản khi điều trị với itraconazol.
Hydroxypropyl-β-cyclodextrin (HP-β-CD)
Những nghiên cứu độc tính của liều đơn và liều lặp lại trên chuột nhắt, chuột cống và chó cho thấy giới hạn an toàn rộng sau khi uống và tiêm tĩnh mạch HP-β-CD. Hầu hết các tác động đều được điều chỉnh về bản chất (những thay đổi mô học trong đường niệu, làm mềm phân liên quan đến sự giữ nước thẩm thấu ở ruột già, hoạt hóa hệ thống thực bào đơn nhân) và cho thấy khả năng hồi phục tốt.
Sự thay đổi nhẹ ở gan xảy ra với liều cao gấp 30 lần liều HP-β-CD khuyến nghị sử dụng trên người.
HP-β-CD liều 1200 mg/kg dùng đường uống điều trị cho chó săn chưa trưởng thành trong giai đoạn kéo dài đến 13 tuần với một giai đoạn hồi phục 4 tuần đã cho thấy dung nạp tốt trên lâm sàng với việc không ghi nhận có ảnh hưởng nào khi so sánh với các động vật đối chứng trong kiểm tra mô bệnh học hoặc xét nghiệm.
Khả năng gây ung thư và đột biến gen
Không có bằng chứng hoạt tính gây ung thư nguyên phát nào ở nghiên cứu về khả năng gây ung thư trên chuột nhắt. Nghiên cứu về khả năng gây ung thư trên chuột cống cho thấy có sự gia tăng tỷ lệ ung thư ở ruột già (ở mức liều 5000 mg/kg/ngày) và ở tuyến tụy ngoại tiết (từ mức liều 500 mg/kg/ngày). Dựa trên tính toán liều tương đương ở người được chuẩn hóa theo diện tích bề mặt cơ thể, liều khuyến cáo trên lâm sàng của SPORANOX dung dịch uống chứa xấp xỉ 1,7 lần lượng HP-β-CD có trong liều 500 mg/kg/ngày dùng ở chuột cống trong nghiên cứu về khả năng gây ung thư này.
Tỷ lệ ung thư tuyến cao hơn không đáng kể ở ruột già, tỷ lệ này có liên quan với sự phì đại/tăng sinh và thay đổi dễ bị viêm ở niêm mạc ruột kết gây ra bởi áp lực thẩm thấu tăng lên do HP-β-CD và được xem là có mối liên quan thấp trên lâm sàng. Sự hình thành của u tuyến tụy có liên quan đến hoạt động phân bào của nội tiết tố cholecystokinin ở chuột cống. Điều này đã không được quan sát thấy trong nghiên cứu khả năng gây ung thư trên chuột nhắt, cũng như không thấy trong nghiên cứu độc tính ở chó trong 12 tháng hay trong nghiên cứu độc tính ở khỉ cái trong 2 năm. Không có bằng chứng cho thấy cholecystokinin có hoạt động phân bào ở người. Tuy nhiên, không có mối tương quan trên lâm sàng của những kết quả này.
HP-β-CD không gây đột biến gen. Cấu trúc hóa học của HP-β-CD cũng không gây nghi ngờ khả năng gây độc gen. Những xét nghiệm đánh giá các tổn thương trên DNA, đột biến gen và bất thường nhiễm sắc thể in vitro và in vivo đã không cho thấy bất kỳ tác động gây độc trên gen nào.
Độc tính trên sinh sản: HP-β-CD không có ảnh hưởng trực tiếp gây độc trên phôi thai và không gây quái thai.
Khả năng sinh sản: HP-β-CD không có tác động chống lại khả năng sinh sản.
6.5 Tài liệu tham khảo:
Dược Thư Quốc Gia Việt Nam



